《(江蘇專用)2022屆高考化學(xué)二輪復(fù)習(xí) 滾動(dòng)練3》由會(huì)員分享���,可在線閱讀����,更多相關(guān)《(江蘇專用)2022屆高考化學(xué)二輪復(fù)習(xí) 滾動(dòng)練3(6頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索��。
1�、(江蘇專用)2022屆高考化學(xué)二輪復(fù)習(xí) 滾動(dòng)練3
一、選擇題
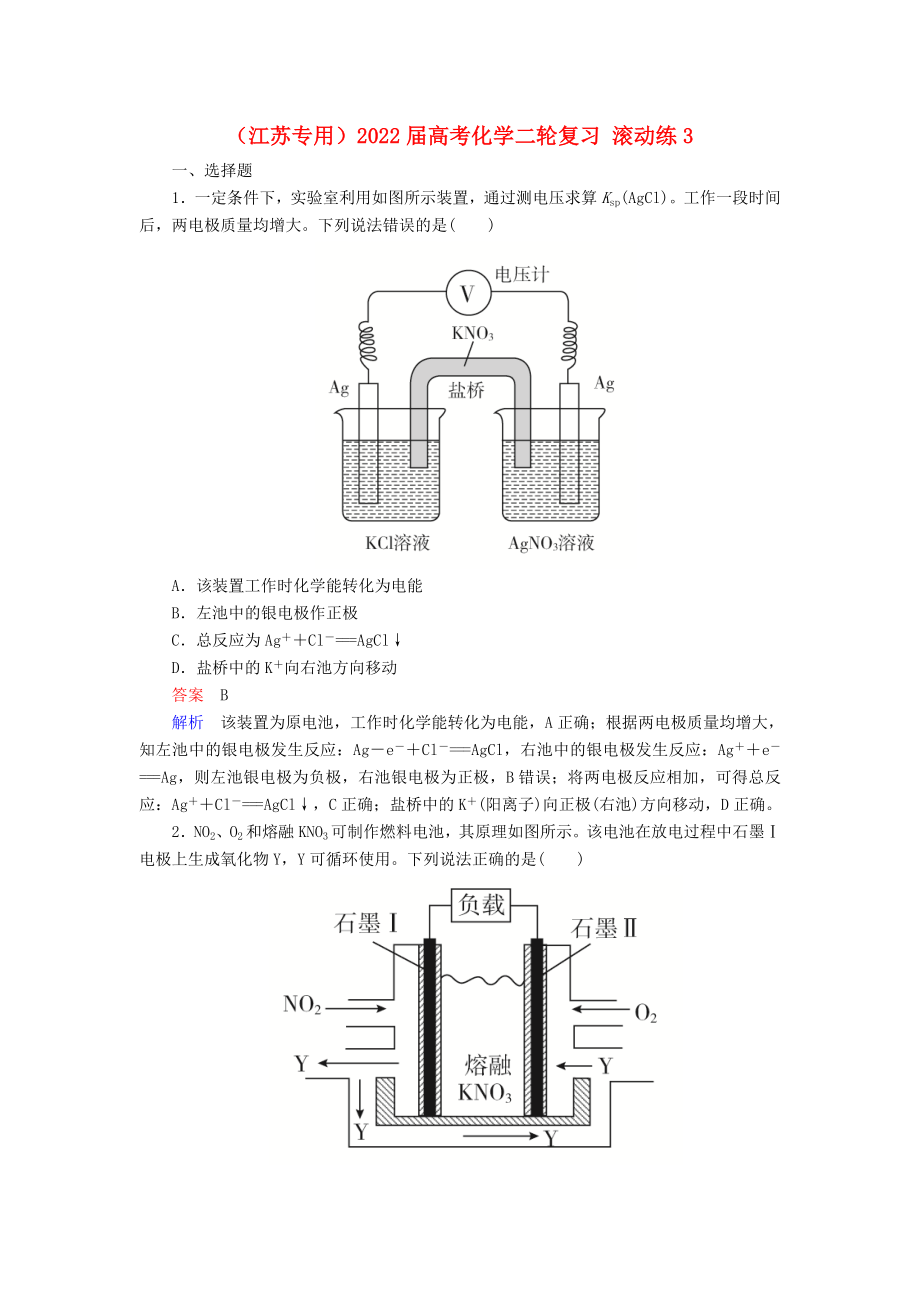
1.一定條件下�����,實(shí)驗(yàn)室利用如圖所示裝置�,通過測電壓求算Ksp(AgCl)。工作一段時(shí)間后���,兩電極質(zhì)量均增大���。下列說法錯(cuò)誤的是( )
A.該裝置工作時(shí)化學(xué)能轉(zhuǎn)化為電能
B.左池中的銀電極作正極
C.總反應(yīng)為Ag++Cl-===AgCl↓
D.鹽橋中的K+向右池方向移動(dòng)
答案 B
解析 該裝置為原電池,工作時(shí)化學(xué)能轉(zhuǎn)化為電能����,A正確;根據(jù)兩電極質(zhì)量均增大�,知左池中的銀電極發(fā)生反應(yīng):Ag-e-+Cl-===AgCl,右池中的銀電極發(fā)生反應(yīng):Ag++e-===Ag��,則左池銀電極為負(fù)極�����,右池銀電極為正極�,B錯(cuò)誤;將兩電極
2�����、反應(yīng)相加�����,可得總反應(yīng):Ag++Cl-===AgCl↓�,C正確;鹽橋中的K+(陽離子)向正極(右池)方向移動(dòng)���,D正確��。
2.NO2��、O2和熔融KNO3可制作燃料電池����,其原理如圖所示。該電池在放電過程中石墨Ⅰ電極上生成氧化物Y�����,Y可循環(huán)使用��。下列說法正確的是( )
A.放電時(shí)����,NO向石墨Ⅱ電極遷移
B.石墨Ⅱ附近發(fā)生的反應(yīng)為:NO+O2+e-===NO
C.該電池總反應(yīng)式為:4NO2+O2===2N2O5
D.當(dāng)外電路通過4 mol e-時(shí),負(fù)極上共產(chǎn)生2 mol N2O5
答案 C
解析 根據(jù)燃料電池的工作原理可知����,石墨Ⅰ上通入NO2,石墨Ⅰ為負(fù)極�,石墨Ⅱ上通入O2,石墨Ⅱ?yàn)?/p>
3��、正極�,放電時(shí)NO向負(fù)極(石墨Ⅰ)遷移,A錯(cuò)誤����;石墨Ⅱ附近發(fā)生的反應(yīng)為:O2+4e-+2N2O5===4NO,B錯(cuò)誤�����;電池總反應(yīng)為NO2和O2的反應(yīng):4NO2+O2===2N2O5�,C正確;根據(jù)負(fù)極反應(yīng)式:4NO2-4e-+4NO===4N2O5可知�,當(dāng)外電路通過4 mol e-時(shí),負(fù)極上共產(chǎn)生4 mol N2O5�����,D錯(cuò)誤��。
3.向100 mL 0.4 mol·L-1的氫氧化鋇溶液中加入足量稀硫酸充分反應(yīng)后����,放出5.12 kJ的熱量。如果向100 mL 0.4 mol·L-1的稀鹽酸中加入足量氫氧化鋇溶液充分反應(yīng)后����,放出2.2 kJ的熱量,則硫酸鈉溶液與氯化鋇溶液反應(yīng)的熱化學(xué)方程式為( )
4�、
A.Ba2+(aq)+SO(aq)===BaSO4(s)
ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO(aq)===BaSO4(s)
ΔH=-0.72 kJ·mol-1
C.Ba2+(aq)+SO(aq)===BaSO4(s)
ΔH=-18 kJ·mol-1
D.Ba2+(aq)+SO(aq)===BaSO4(s)
ΔH=-73 kJ·mol-1
答案 C
解析 第一個(gè)反應(yīng)中Ba(OH)2和第二個(gè)反應(yīng)中HCl的物質(zhì)的量均為:0.4 mol·L-1×0.1 L=0.04 mol�,則Ba(OH)2溶液與足量稀硫酸反應(yīng)的熱化學(xué)方程式為:①Ba2+(aq)+2OH
5����、-(aq)+2H+(aq)+SO(aq)===BaSO4(s)+2H2O(l) ΔH1=-=-128 kJ·mol-1;鹽酸與足量Ba(OH)2溶液反應(yīng)的熱化學(xué)方程式為:②H+(aq)+OH-(aq)===H2O(l) ΔH2=-=-55 kJ·mol-1���。Na2SO4溶液與BaCl2溶液反應(yīng)的熱化學(xué)方程式為:③Ba2+(aq)+SO(aq)===BaSO4(s)�,根據(jù)蓋斯定律�����,由①-②×2可得③�����,則ΔH=ΔH1-2ΔH2=-128 kJ·mol-1-(-55 kJ·mol-1)×2=-18 kJ·mol-1��,C正確��。
4.用間接電化學(xué)法可對大氣污染物NO進(jìn)行無害化處理�����,其工作原理如圖所示,
6��、質(zhì)子膜允許H+和H2O通過���。下列說法正確的是( )
A.電極Ⅰ為陰極���,電極反應(yīng)式為2H2O+2e-===2OH-+H2↑
B.電解時(shí)H+由電極Ⅰ向電極Ⅱ遷移
C.吸收塔中的反應(yīng)為2NO+2S2O+2H2O===N2+4HSO
D.每處理1 mol NO��,可同時(shí)得到32 g O2
答案 C
解析 根據(jù)圖示可以看出��,電極Ⅰ中的電極反應(yīng)式應(yīng)該是2HSO+2e-+2H+===S2O+2H2O����,A錯(cuò)誤;電解時(shí)陽離子向陰極移動(dòng)�����,故H+由電極Ⅱ向電極Ⅰ遷移���,B錯(cuò)誤����;吸收塔中的反應(yīng)為2NO+2S2O+2H2O===N2+4HSO,C正確���;每處理1 mol NO�����,轉(zhuǎn)移電子數(shù)為2 mol����,可同時(shí)
7�、得到16 g O2,D錯(cuò)誤�。
5.裝置(Ⅰ)為鐵鎳(Fe-Ni)可充電的堿性電池:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2;裝置(Ⅱ)為電解示意圖�。當(dāng)閉合開關(guān)K時(shí),電極Y附近溶液先變紅�。X、Y電極為惰性電極��。下列說法正確的是( )
A.閉合K時(shí)����,電極X上有無色無味的氣體產(chǎn)生
B.閉合K時(shí),電極X的反應(yīng)式為2Cl--2e-===Cl2↑
C.閉合K時(shí)����,電子從電極A流向電極X
D.閉合K時(shí)�,A電極反應(yīng)式為NiO2+2e-+2H+===Ni(OH)2
答案 B
解析 由電極Y附近溶液先變紅����,可知Y為陰極,則X為陽極�����,Cl-在陽極發(fā)生失電子的氧化反應(yīng):2Cl--2e-
8�����、===Cl2↑����,A錯(cuò)誤�����,B正確�����;B極為負(fù)極,電子由電極B流向電極Y�����,由電極X流向電極A�,C錯(cuò)誤;A極為正極��,NiO2得電子被還原����,且該電池為堿性電池,電極反應(yīng)式中不能出現(xiàn)H+��,故正極反應(yīng)式為NiO2+2H2O+2e-===Ni(OH)2+2OH-����,D錯(cuò)誤。
6.某反應(yīng)由AB�、BC兩步反應(yīng)構(gòu)成,反應(yīng)的能量變化曲線如圖所示�����,E1���、E2��、E3����、E4表示活化能,下列有關(guān)該反應(yīng)的ΔH的計(jì)算正確的是( )
A.ΔH=(E1+E2)-(E4+E3)
B.ΔH=(E4+E3)-(E1+E2)
C.ΔH=(E1+E2+E3)-E4
D.ΔH=(E1+E3)-(E2+E4)
答案 D
9�、解析 E1和E3均可看做斷裂舊化學(xué)鍵吸收的能量,而E2和E4均可看做生成新化學(xué)鍵放出的能量�����,故反應(yīng)的ΔH=(E1+E3)-(E2+E4)�����。
7.如下圖所示��,某同學(xué)設(shè)計(jì)了一個(gè)燃料電池并探究氯堿工業(yè)原理和粗銅的精煉原理�,其中乙裝置中X為陽離子交換膜���。下列有關(guān)說法正確的是( )
A.反應(yīng)一段時(shí)間后����,乙裝置中生成的氫氧化鈉在鐵極區(qū)
B.乙裝置中鐵電極為陰極,電極反應(yīng)式為Fe-2e-===Fe2+
C.通入氧氣的一極為正極�����,發(fā)生的電極反應(yīng)為O2-4e-+2H2O===4OH-
D.反應(yīng)一段時(shí)間后����,丙裝置中硫酸銅溶液濃度保持不變
答案 A
解析 甲裝置中通入甲醚的電極為負(fù)極,則Fe電極
10��、為陰極��,Na+�、H+向陰極移動(dòng),H+放電����,OH-濃度增大,故鐵極區(qū)生成NaOH�,A正確;乙裝置中鐵電極為陰極��,陰極上Fe不參與反應(yīng)�,H+得電子發(fā)生還原反應(yīng),B錯(cuò)誤�����;通入O2的電極為正極,發(fā)生得電子的還原反應(yīng):O2+4e-+2H2O===4OH-��,C錯(cuò)誤���;丙裝置中陽極粗銅上不僅Cu放電���,雜質(zhì)Fe、Zn等也放電��,而陰極上始終是Cu2+放電�,即進(jìn)入溶液中的Cu2+比溶液中析出的Cu2+少,故CuSO4溶液濃度減小�,D錯(cuò)誤。
二��、填空題
8.按要求計(jì)算下列反應(yīng)的ΔH����。
(1)二氧化碳的捕集與利用是實(shí)現(xiàn)溫室氣體減排的重要途徑之一�。
目前工業(yè)上用的捕碳劑NH3和(NH4)2CO3,它們與CO2發(fā)生
11�、如下可逆反應(yīng):
2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1
NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
則ΔH3=______________(用含ΔH1��、ΔH2的代數(shù)式表示)�����。
(2)已知斷裂1 mol化學(xué)鍵所需的能量如下:
化學(xué)鍵
H—H
C===O
C===S
H—S
C≡O(shè)
E/(kJ·mol-1)
436
745
577
339
1072
H2還原COS發(fā)生的反應(yīng)為H2(g)+COS(g)
12��、===H2S(g)+CO(g)�,該反應(yīng)的ΔH=________ kJ·mol-1(已知COS的電子式O··, ··C··S··, )��。
(3)NH3作為一種重要化工原料��,被大量應(yīng)用于工業(yè)生產(chǎn)����,與其有關(guān)性質(zhì)反應(yīng)的催化劑研究曾被列入國家863計(jì)劃。催化劑常具有較強(qiáng)的選擇性����,即專一性。已知:
反應(yīng)Ⅰ:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH1=-905.0 kJ·mol-1
反應(yīng)Ⅱ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH2
化學(xué)鍵
H—O
O===O
N≡N
N—H
鍵能/(kJ·mol-1)
463
496
942
391
13�、ΔH2=____________。
(4)以甲醇為原料制備氫氣的一種原理如下:
反應(yīng)Ⅰ:CH3OH(g)CO(g)+2H2(g)
ΔH1=+90 kJ·mol-1
反應(yīng)Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g)
ΔH2=-41 kJ·mol-1
已知:斷裂1 mol分子中的化學(xué)鍵需要吸收的能量如下表所示�。
分子
CH3OH(g)
H2(g)
H2O(g)
CO2(g)
能量/(kJ·mol-1)
2038
436
925
x
表中x=________。
(5)利用CO2和CH4重整可制合成氣(主要成分為CO���、H2)��,已知重整過程中部分反應(yīng)的
14�����、熱化學(xué)方程式為
①CH4(g)===C(s)+2H2(g)
ΔH1=+75.0 kJ·mol-1
②CO2(g)+H2(g)===CO(g)+H2O(g)
ΔH2=+41.0 kJ·mol-1
③CO(g)+H2(g)===C(s)+H2O(g)
ΔH3=-131.0 kJ·mol-1
反應(yīng)CO2(g)+CH4(g)===2CO(g)+2H2(g)的ΔH=________ kJ·mol-1��。
答案 (1)2ΔH2-ΔH1 (2)+8 (3)-1260 kJ·mol-1 (4)1606 (5)+247.0
解析 (1)①2NH3(l)+H2O(l)+CO2(g)(NH4)2
15��、CO3(aq) ΔH1
②NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
根據(jù)蓋斯定律②×2-①可得:(NH4)2CO3(aq)+H2O(l)+CO2(g)
2NH4HCO3(aq) ΔH3=2ΔH2-ΔH1���。
(2)ΔH=(436+745+577-2×339-1072) kJ·mol-1=+8 kJ·mol-1���。
(3)4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH2=反應(yīng)物的鍵能總和-生成物的鍵能總和=(4×3×391+3×496-2×942-6×2×463) kJ·mol-1=-1260 kJ·mol-1。
(4)根據(jù)蓋斯定律Ⅰ+Ⅱ可得:CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH=+49 kJ·mol-1�,因?yàn)棣=反應(yīng)物的鍵能總和-生成物的鍵能總和=(2038+925-x-436×3) kJ·mol-1=49 kJ·mol-1,解得x=1606��,所以表中x=1606��。
(5)根據(jù)蓋斯定律①+②-③可得反應(yīng):CO2(g)+CH4(g)===2CO(g)+2H2(g) ΔH=ΔH1+ΔH2-ΔH3=75.0 kJ·mol-1+41.0 kJ·mol-1-(-131.0 kJ·mol-1)=+247.0 kJ·mol-1��。
 (江蘇專用)2022屆高考化學(xué)二輪復(fù)習(xí) 滾動(dòng)練3
(江蘇專用)2022屆高考化學(xué)二輪復(fù)習(xí) 滾動(dòng)練3